Il calore terrestre, la radioattività naturale e il rischio da esposizione eccessiva.
Il calore terrestre, la radioattività naturale e il rischio da esposizione eccessiva.
di Pasquale Falco
 La Terra è riscaldata dal sole, ma a sua volta possiede un calore proprio che si genera al suo interno e che produce fenomeni geologici a scala planetaria: grazie a questi meccanismi la Terra è un pianeta “che vive”. Ma da dove viene questo calore? A cosa è dovuto, atteso che la terra è un pianeta e non una stella come il sole? La radioattività naturale è la risposta: il decadimento naturale di alcuni elementi, i cui atomi “si trasformano” in altri atomi e quindi in altri elementi, produce radiazioni, contribuisce al calore geotermico, fa vivere la terra, è può costituire per l’uomo un rischio quando la esposizione alla radioattività naturale diventa eccessiva.
La Terra è riscaldata dal sole, ma a sua volta possiede un calore proprio che si genera al suo interno e che produce fenomeni geologici a scala planetaria: grazie a questi meccanismi la Terra è un pianeta “che vive”. Ma da dove viene questo calore? A cosa è dovuto, atteso che la terra è un pianeta e non una stella come il sole? La radioattività naturale è la risposta: il decadimento naturale di alcuni elementi, i cui atomi “si trasformano” in altri atomi e quindi in altri elementi, produce radiazioni, contribuisce al calore geotermico, fa vivere la terra, è può costituire per l’uomo un rischio quando la esposizione alla radioattività naturale diventa eccessiva.
La terra è un pianeta baciato dalle stelle, da una in particolare, il nostro sole.
È grazie proprio al sole, posto alla giusta distanza e dispensatore gratuito di luce e calore, che si è sviluppata la vita sulla terra: in tutte le sue molteplici forme, microscopiche e macroscopiche, vegetali e animali, col genere umano a governare questa biosfera unica.
La nostra terra, però, non solo accoglie la vita: a sua volta è essa stessa un pianeta che vive, in quanto evolve e cambia.
I complessi processi, che avvengono al suo interno, non osservabili direttamente, hanno, come evidenze esterne visibili, fenomeni geologici estesi o puntuali, ma comunque straordinari.
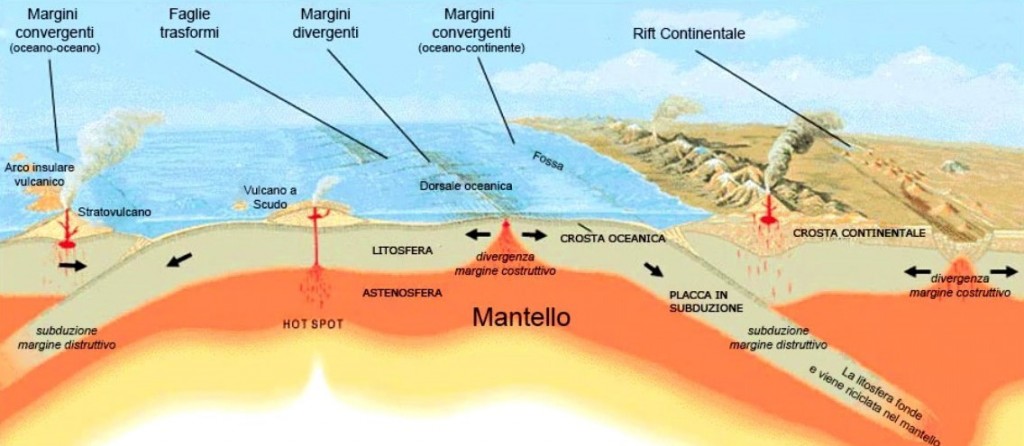
Sulla superficie della terra infatti osserviamo (figura 1):
- continenti-placche che si scontrano, o si allontanano o si spostano;
- fondali oceanici che si aprono in lunghe fessure e lava incandescente che, solidificando a contatto con l’acqua, le richiude;
- fosse abissali sottomarine in corrispondenza di aree in cui la crosta oceanica subduce (cioè si infila sotto altra crosta);
- crosta continentale che si scontra con altra crosta continentale, facendo nascere estese catene montuose (orogenesi);
- vulcani terrestri e sottomarini che emettono rocce piroclastiche e lave;
- ma anche manifestazioni meno estese, quali campi geotermici e geyser di acque calde
Il propulsore di tutti questi fenomeni è il calore, ma un calore diverso da quello che ci arriva dal sole.
È l’energia geotermica presente all’interno della terra e che si distribuisce tra nucleo centrale e mantello, fino alla crosta, da cui tende a disperdersi verso l’esterno.
Per inciso un buon paragone per la terra è la mela, anche in termini di spessori: il nucleo rappresenta la parte centrale dove si trovano i semi, il mantello è la polpa e la crosta è la buccia.
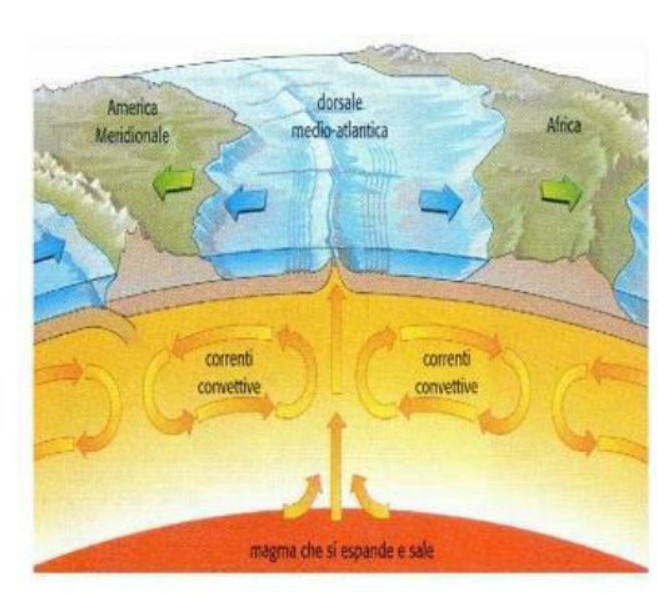
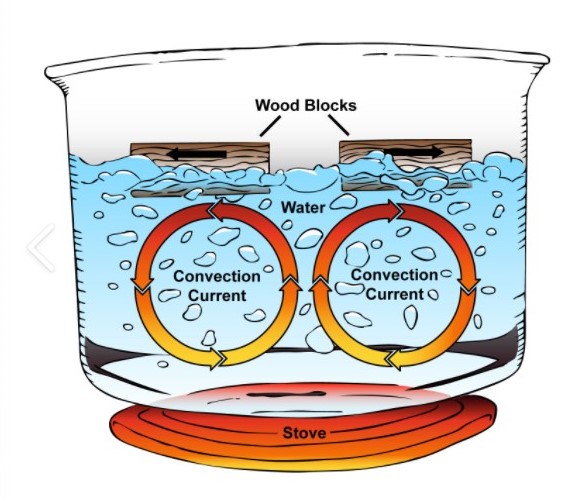
Il calore geotermico riscalda a tal punto le rocce dell’astenosfera (la parte più esterna del mantello, dove la pressione delle rocce soprastanti è minore) da renderle un magma plastico, anche se non completamente fuso, e le induce a creare dei moti convettivi che spostano i continenti soprastanti (figura 2), proprio come avviene nella pentola in cui sta bollendo dell’acqua (figura 3). Nell’esperimento della pentola, la conseguenza del trascinamento operato dai moti convettivi è evidenziata dallo spostamento in superficie dei due pezzetti di legno, che si allontanano perché spinti dalle sottostanti correnti convettive nell’acqua.
Ovviamente, nel caso della terra gli spostamenti dei continenti/placche tettoniche sono fenomeni che avvengono in tempi molto lunghi, i cosiddetti tempi geologici: per dare un’idea, il continente americano si allontana dall’Europa 4 centimetri l’anno.
Quando due continenti si allontanano e un oceano si espande è perché si sta formando nuova crosta; nel contempo a migliaia di chilometri di distanza vecchia crosta si distrugge, affondando letteralmente sotto altra crosta.
Queste zone di distruzione e di creazione di crosta si caratterizzano anche per essere accompagnate da esteso vulcanismo e per essere aree sismogenetiche (dove si producono frequenti terremoti).
Se il calore, motore dei fenomeni descritti, non è quello che arriva dal sole, allora da dove viene questa energia geotermica?
La risposta è nella radioattività naturale prodotta da alcuni elementi chimici all’interno della terra; si calcola che oltre il 50% del calore geotermico derivi da essa, mentre la restante quota è costituita dal calore intrappolato durante le fasi della formazione del pianeta terra e del suo accrescimento.
Per comprendere la radioattività, dopo averne visto le conseguenze a scala planetaria, è necessario scendere a scala oltre che microscopica: la radioattività, infatti, dipende esclusivamente da cambiamenti della struttura di quel “mattoncino” di cui è costituita tutta la materia che ci circonda, sia essa solida o liquida o gassosa, l’atomo.
L’atomo di un elemento chimico generico (la tavola periodica elenca tutti quelli finora noti) risulta costituito da tre particelle elementari.
Nel nucleo centrale sono presenti i protoni, carichi positivamente, mentre gli elettroni, carichi negativamente, ruotano, seguendo traiettorie orbitali, all’esterno del nucleo.
Il numero di elettroni bilancia quello dei protoni, per cui l’atomo normalmente è neutro.
Nel nucleo sono presenti anche i neutroni, che, hanno carica elettrica pari a 0; protoni e neutroni sono legati nel nucleo da forze molto intense, dette forze nucleari (figura 4).
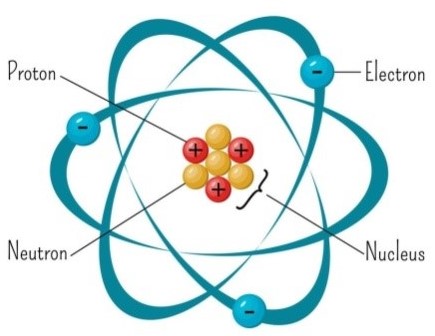 Figura 4
Figura 4
Ogni elemento chimico si differenzia dagli altri per avere nel nucleo un numero fisso di protoni che è diverso per ogni elemento; ad esempio, l’elio, il gas col quale gonfiamo i palloncini, ha nel suo atomo 2 protoni e si dirà che ha numero atomico (Z) pari a 2, il ferro 26 protoni (Z=26), l’argento 47 (Z=47), l’oro 79 (Z=79).
È il numero atomico che distingue gli atomi dei diversi elementi e ne determina le caratteristiche chimiche.
Anche la massa determina alcune differenze tra gli atomi: la gran parte della massa di un atomo è dovuta ai protoni e ai neutroni, mentre la massa degli elettroni è trascurabile.
Il numero totale di protoni e di neutroni nel nucleo di un atomo è il numero di massa (A).
Un elemento può avere atomi con diversi numeri di massa, cui corrispondono diversi numeri di neutroni; in tal caso si dice che sono isotopi dello stesso elemento.
Ad esempio l’idrogeno ha tre isotopi, il carbonio ne ha tre, il cloro ne ha due.
La maggior parte dei nuclei presenti in natura è stabile nel tempo, perché nel complesso alle cariche positive fanno da contraltare le cariche negative degli elettroni; ci sono, al contrario, alcuni elementi i cui nuclei hanno stipato in un volume piccolissimo un numero sempre crescente di protoni e neutroni.
Quando i protoni sono in numero troppo elevato (Z>83), il nucleo diventa instabile. Le forze nucleari vengono vinte, alcune particelle si liberano e vengono emesse particolari tipi di radiazioni: si ha così il decadimento radioattivo e la radioattività, a seguito della quale un elemento decade, cioè si trasforma letteralmente in un altro elemento, e nel contempo emette radiazioni, cioè energia.
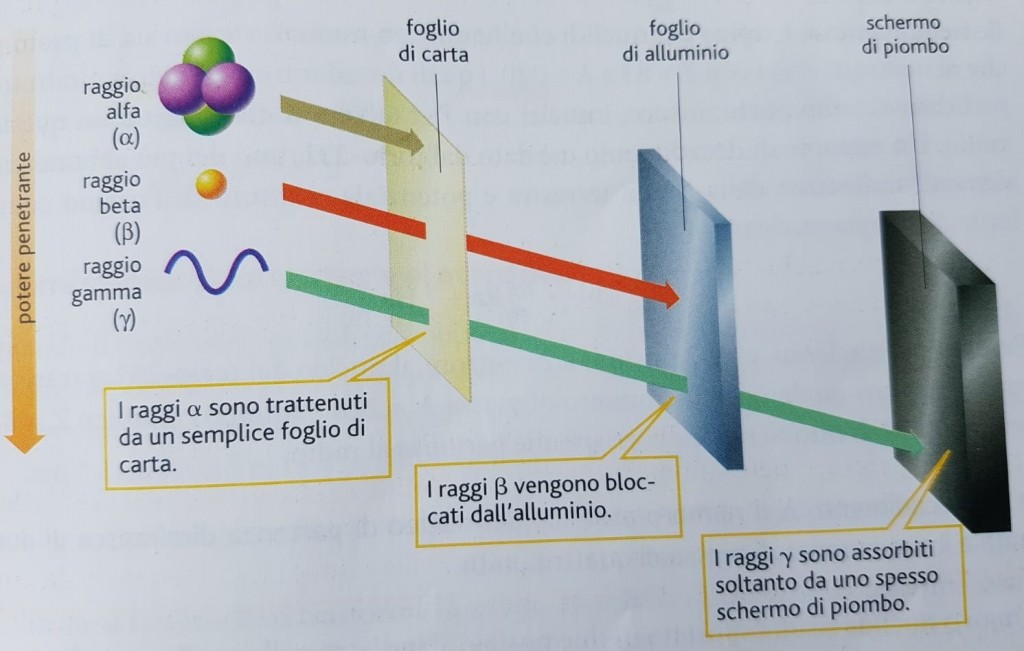
La radioattività genera tre distinti tipi di raggi: alfa (α), beta (β) e gamma (γ), con diverse capacità di penetrazione (figura 5).
Quando una radiazione trasporta una quantità rilevante di energia tale da riuscire a strappare elettroni agli atomi o alle molecole attraversate, si definisce ionizzante e può causare profonde alterazioni anche nei tessuti viventi.
D’altro canto, questa capacità di danneggiare i tessuti, ne consente un utilizzo terapeutico nella lotta ai tumori, permettendo di raggiungere e distruggere cellule cancerose di tumori profondi (con gli isotopi del cobalto e dello iodio).
Un altro utilizzo pratico degli isotopi radioattivi è quello del tracciamento, in quanto, preventivamente miscelati con altre sostanze, grazie all’emissione di radiazioni, ne può indicare la localizzazione e il percorso.
Ogni isotopo radioattivo decade seguendo una propria legge temporale che è basata sul tempo di dimezzamento, cioè sul tempo occorrente per ridurre della metà la quantità di isotopo radioattivo iniziale.
Alcuni isotopi presentano tempo di dimezzamento breve, pari a pochi giorni o anni, altri estremamente lungo, corrispondente a migliaia o milioni di anni; questa proprietà consente un ulteriore utilizzo di alcuni isotopi (il carbonio 14 e, per tempi più lunghi, del potassio 40) per la datazione di reperti.
Molto spesso il decadimento di un isotopo radioattivo non porta alla formazione di un isotopo stabile, ma alla formazione di un nuovo isotopo radioattivo, che a sua volta decade; tale processo può continuare fino a quando non si forma un isotopo stabile.
Questa successione di decadimenti fino alla formazione di un isotopo stabile prende il nome di serie di disintegrazione radioattiva, tra cui si ricorda quella che porta anche alla formazione del radon.
L’esposizione prolungata a tale isotopo in ambienti chiusi è stata oggetto di diversi interventi normativi recenti.
Ogni persona è esposta alla radioattività naturale, ma anche alle sostanze radioattive presenti nell’ambiente e negli alimenti.
A queste fonti possono aggiungersi le radiazioni di origine artificiale, che derivano dalle cure mediche, oppure dalle attività industriali e di ricerca, e infine dagli esperimenti o usi delle armi nucleari, costituendo un vero pericolo quando si è esposti a esse per lungo tempo, tenuto conto che l’Agenzia Internazionale per la Ricerca sul Cancro classifica tutte queste radiazioni ionizzanti come “sicuramente cancerogene per l’uomo”, indipendentemente dalla quantità di energia rilasciata e dal potere di penetrazione.
Napoli, 19 aprile 2021